Para o recém-nascido, os benefícios da amamentação são reconhecidamente numerosos. O leite materno é um ali mento balanceado, nutritivo e seguro, que contém vitaminas e gorduras saudáveis, além de proteínas – como anticorpos maternos e citocinas (moléculas envolvidas no desencadeamento da resposta imune) – que protegem o bebê e estimulam seu sistema imunológico, preparando-o para combater infecções. Estudos têm demonstrado que recém-nascidos alimentados com leite materno têm menor propensão a desenvolver doenças respiratórias, alergias, diabetes e obesidade. Parece perfeito? O que mais poderíamos esperar de um alimento para nossos pequenos filhos? A resposta para essa pergunta é surpreendente e insólita: bactérias.
Um leitor desavisado pode estar se perguntando por que, afinal, uma mãe gostaria do seu precioso leite materno contaminado com bactérias. Vamos esclarecer: micro-organismos fazem parte da nossa vida e estão presentes em vários locais do nosso corpo. A pele, a boca e o trato gastrointestinal são pesadamente colonizados por bactérias, fungos e vírus. Esses micro-organismos compõem a chamada microbiota humana normal e são essenciais para o funcionamento perfeito do nosso corpo, ou seja, sem eles nossa saúde não seria completa. Estima-se que apenas no nosso intestino grosso exista um número de bactérias duas vezes maior do que o total de células humanas que formam todos os tecidos e órgãos do corpo. Além de colonizar nosso trato gastrointestinal, essas bactérias estão trabalhando ativamente em prol da nossa saúde e nos trazem diversos benefícios, como produção de vitaminas, auxílio à digestão de carboidratos complexos, estímulo ao sistema imunológico e proteção contra bactérias causadoras de doenças.
Apesar de nossa microbiota nos acompanhar durante nossa vida, ela não está definida quando nascemos. Ficamos livres de bactérias no útero materno. No parto, somos imediatamente colonizados por milhares de micro-organismos e, sem isso, provavelmente não sobreviveríamos.
Estudos em animais de laboratório indicam que a ausência da microbiota normal causa graves problemas nutricionais e imunológicos, tornando-os mais suscetíveis a infecções. Em humanos, diversas doenças têm sido associadas ao desequilíbrio nas populações de micro-organismos presentes no nosso corpo, entre elas, infecções e doenças do trato gastrointestinal (como a síndrome do intestino irritado). Além disso, autismo, depressão, diabetes tipo 2 e alergias podem estar associados a uma microbiota defeituosa. Muitos autores acreditam que a importância da microbiota intestinal no surgimento dessas doenças é maior nos primeiros anos de vida, quando o organismo humano ainda está em formação. Desvendar a composição da nossa microbiota e definir o que caracteriza uma microbiota saudável é uma das questões mais relevantes na ciência médica humana atual, e talvez a resposta esteja precisamente no valioso leite materno.
Inumeráveis bactérias do leite
Já sabemos há muitas décadas que mulheres saudáveis têm em média de 1 mil a 10 mil células bacterianas por mililitro (ml) de leite. A maioria das bactérias identificadas no leite materno por métodos convencionais de laboratório, baseados na observação do crescimento dos micro-organismos em meios artificiais, pertence aos gêneros Staphyloccocus, Streptoccocus, Lactobacillus e Bifidobacterium. Apesar de importantes, esses resultados mostram uma imagem distorcida da realidade, já que nós, pesquisadores, não sabemos como cultivar em laboratório todos os tipos de bactérias existentes.
Para contornar esse problema e tentar identificar todas as bactérias do leite materno, têm sido empregadas análises sofisticadas baseadas na leitura de sequências de DNA. Essas análises nos fornecem uma representação qualitativa e quantitativa das espécies bacterianas presentes em uma amostra, sem a necessidade de cultivá-las em laboratório. Além dos gêneros já mencionados, vários outros gêneros bacterianos tiveram seu DNA encontrado, incluindo Pseudomonas, Edwardsiella, Akkermansia e Campylobacter. No total, mais de 170 gêneros bacterianos já foram descritos em amostras de leite materno; porém, essa população é muito variável entre diferentes indivíduos e pode inclusive se alterar ao longo do período de amamentação, de acordo com a saúde da mãe.
Tradicionalmente, tem sido postulado que as bactérias do leite materno são provenientes da contaminação por bactérias da pele humana ou por refluxo da boca do lactente para a glândula mamária. Porém, uma explicação alternativa e muito interessante vem ganhando força nos últimos anos. Estudos recentes demonstraram que células do sistema imunológico da mãe, como macrófagos e células dendríticas, podem capturar bactérias do intestino materno e transportá-las diretamente para a glândula mamária, suplementando o leite e provendo o recém-nascido com a tão cobiçada microbiota saudável.

Esses macrófagos e células dendríticas estão presentes na mucosa do nosso intestino, mais especificamente no tecido linfoide associado ao trato gastrointestinal, que atua como um posto avançado de vigilância do sistema imune humano. Amostras do conteúdo intestinal, incluindo bactérias e moléculas originárias da nossa dieta, são constan temente capturadas por essas células e apresentadas ao nosso sistema imunológico no tecido linfoide. Algumas vezes, essas bactérias e moléculas são transportadas por nosso sistema linfático para outros órgãos do sistema imune, como os gânglios linfáticos (linfonodos) presentes no mesentério (dobra membranosa que liga vários órgãos à parede do corpo). Esse é um processo normal e importante para desenvolvermos tolerância às milhares de moléculas que passam pelo nosso trato gastrointestinal todos os dias.
Infelizmente, apesar de necessário, esse processo não é à prova de falhas. Algumas bactérias patogênicas conseguem sobreviver dentro dos macrófagos e das células dendríticas e se espalhar para outros tecidos. Essas bactérias usam nossas células como verdadeiros ‘cavalos de Troia’. Mas será que esse fenômeno é exclusivo de bactérias patogênicas? Afinal, se bactérias patogênicas conseguem burlar esse sistema de vigilância e pegar ‘carona’ em nossas células, por que o mesmo não poderia acontecer com bactérias benéficas?
Transporte sem barreiras
Novos estudos mostraram que o transporte endógeno, ou seja, dentro de nosso próprio organismo, de bactérias do trato gastrointestinal para formar a microbiota do leite materno é possível. Em animais de laboratório, por exemplo, um número significativamente maior de bactérias é encontrado nos gânglios linfáticos mesentéricos de camundongos fêmeas prenhas, em comparação com fêmeas não prenhas, indicando um aumento no transporte de bactérias através da barreira intestinal na gestação. Após o nascimento dos filhotes, essa diferença desaparece. E, coincidentemente, é nesse momento que o número de bactérias nas glândulas mamárias aumenta.
Para confirmar que bactérias do trato gastrointestinal materno podem ser transmitidas para a prole, pesquisadores alimentaram camundongos fêmeas prenhas com bactérias marcadas geneticamente, que podem ser rastreadas com facilidade por testes de laboratório. Essas bactérias foram detectadas nas fezes da prole desses camundongos, mas só após a amamentação. Incrivelmente, em mulheres, hormônios produzidos na gravidez também induzem um aumento no transporte de bactérias do trato gastrointestinal para a corrente sanguínea e as glândulas mamárias. Uma grande dificuldade técnica é coletar o leite materno sem que ocorra contaminação por bactérias da pele. Por outro lado, esse tipo de contaminação não pode explicar a descoberta de que várias bactérias já identificadas no leite materno não são encontradas na pele, mas são habitantes normais do intestino humano.
De fato, é possível observar uma diferença marcante na composição das populações bacterianas em fezes de crianças alimentadas com fórmulas artificiais de leite em relação à de crianças alimentadas exclusivamente com leite materno. Crianças que recebem exclusivamente fórmulas tendem a apresentar espécies com potencial patogênico, como Escherichia coli e Clostridium difficile, com maior frequência. A microbiota de crianças alimentadas exclusivamente com leite materno é mais estável e uniforme em relação à de crianças alimentadas com fórmulas.
Hóspedes prestativos
As bactérias benéficas têm imensa contribuição para a saúde dos recém-nascidos. Elas podem, por exemplo, excluir outras bactérias causadoras de doenças por meio da competição por nutrientes ou pela produção de substâncias antimicrobianas. Esse benefício foi demonstrado em estudo recente no qual bactérias do gênero Lactobacillus isoladas de amostras de leite materno foram dadas como suplemento probiótico (capaz de conferir benefícios à saúde) a recém-nascidos nos primeiros seis meses de vida. O resultado foi que esses bebês apresentaram uma diminuição significativa na taxa de infecções do trato gastrointestinal e do trato respiratório superior. Estudos também indicam que manter a amamentação após o sexto mês de vida do bebê altera sua microbiota intestinal e diminui as chances de obesidade infantil mais tarde (ver ‘Microbiota intestinal, obesidade e dieta’).
Além de fornecer bactérias diretamente para o neonato, o leite materno funciona como um alimento prebiótico. Isso quer dizer que os nutrientes presentes no leite de mulheres saudáveis selecionam e favorecem o crescimento de certas espécies de bactérias benéficas para a saúde humana, como as bifidobactérias. Pesquisas feitas em nosso laboratório – Laboratório de Biologia de Anaeróbios do Instituto de Microbiologia Paulo de Góes, da Universidade Federal do Rio de Janeiro – vêm buscando identificar elementos presentes no leite materno que contribuam para a seleção de bactérias benéficas na microbiota da criança. Um desses elementos, a lactoferrina, é uma proteína que tem atividade antibacteriana, antiviral e antiparasitária. O efeito mais conhecido da lactoferrina é sua ligação ao ferro, o que evita que micro-organismos obtenham esse nutriente importante para seu crescimento.
A lactoferrina do leite materno pode exercer funções fisiológicas importantes no intestino, como atuar positivamente na proliferação celular e em atividades anti-inflamatórias e de defesa do hospedeiro. Além disso, a lactoferrina, quando atinge o trato digestivo, é transformada em uma proteína menor (peptídeo) chamada lactoferricina, que tem efeitos bactericidas derivados da sua capacidade de ligação a gorduras (lipídios) na superfície das bactérias.
Várias espécies de bactérias que causam doenças em humanos, como a Escherichia coli e o Staphyloccocus aureus, são inibidas pela lactoferrina, enquanto bactérias que promovem a saúde são estimuladas. Recentemente, demonstramos que tanto a lactoferrina quanto a lactoferricina não são capazes de inibir o crescimento de duas espécies do gênero Bacteroides, B. fragilis e B. thetaiotaomicron. Essas duas bactérias habitam nosso trato gastrointestinal e, de forma geral, são consideradas benéficas à saúde humana. É sabido que a colonização de nosso intestino por B. fragilis é importante para o desenvolvimento correto de nosso sistema imunológico; já B. thetaiotaomicron tem importante função relacionada ao metabolismo de açúcares complexos que não conseguimos digerir. Esse micro-organismo é capaz de ‘quebrar’ e usar esses açúcares e fornecer compostos intermediários que podem ser usados como fonte de energia por células humanas. Nossos resultados também demonstraram que compostos presentes no leite materno podem influenciar diretamente o crescimento de micro-organismos em nosso corpo, selecionando espécies que beneficiam nossa saúde.
Sem dúvida, o leite materno é uma das principais fontes de bactérias que promovem a saúde do recém-nascido. Como muitas das bactérias do leite vêm diretamente do intestino materno, é importante que a microbiota intestinal da mãe também seja saudável. Atualmente, há muitos estudos com o intuito de desvendar exatamente o que caracteriza uma microbiota intestinal saudável e como o consumo de certos alimentos pode modificar essa microbiota. Esses resultados nos permitirão desenvolver estratégias para manipulação da microbiota intestinal da mãe, por meio do uso de probióticos (micro-organismos benéficos) e prebióticos (nutrientes que estimulam micro-organismos benéficos), por exemplo. As mamães do futuro poderão modificar ou suplementar sua própria alimentação e, dessa forma, favorecer o estabelecimento de uma microbiota intestinal saudável em seus bebês, um benefício que irá durar para toda a vida.
Microbiota intestinal, obesidade e dieta

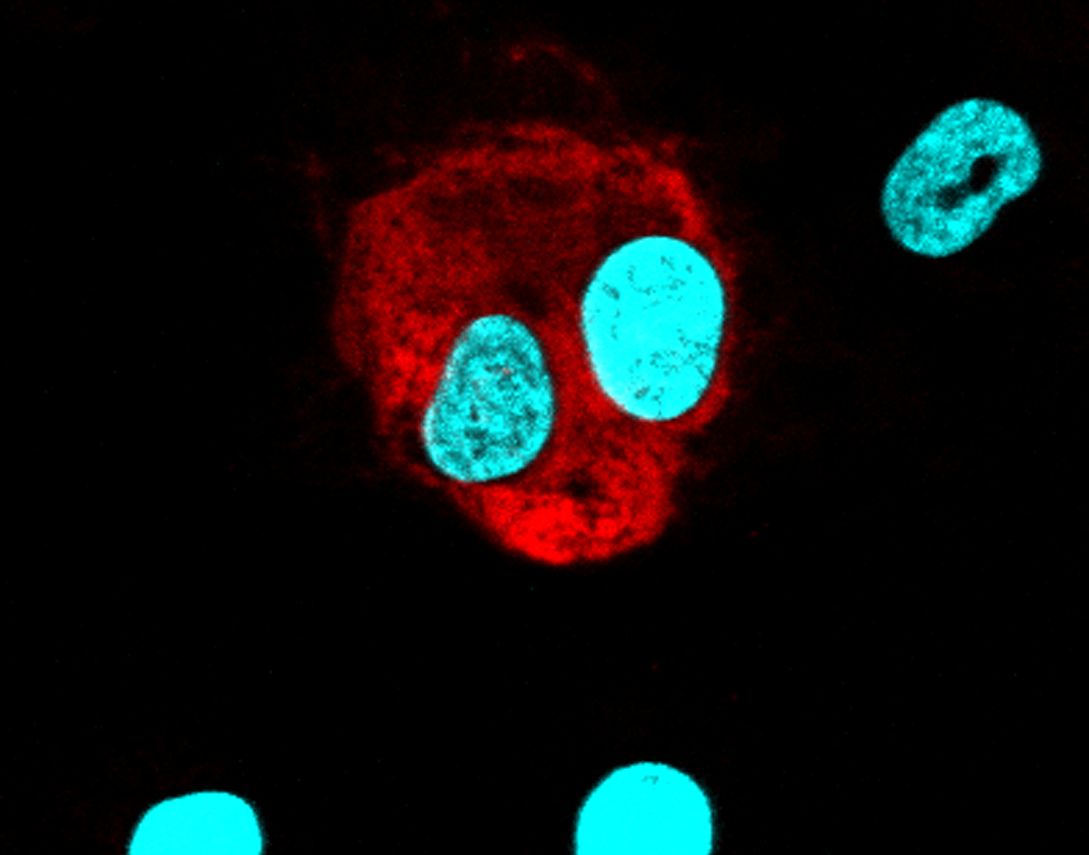
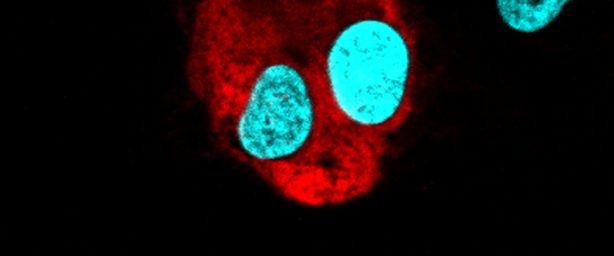
Bactéria da espécie Bacteroides fragilis aderida na superfície de uma célula intestinal, com aumento de 20 mil vezes. (foto: Eliane Ferreira de Oliveira/ UFRJ)
Bactérias que habitam o trato gastrointestinal têm participação muito ativa na digestão humana. Elas ‘quebram’ açúcares complexos e fibras de plantas em pedaços menores que só assim podem ser digeridos pelo nosso organismo. A ação dessas bactérias sobre esses compostos também pode nos fornecer os chamados ácidos graxos de cadeia curta, que podem ser usados diretamente como fonte de energia por nossas células. Esses ácidos graxos servem ainda como moléculas sinalizadoras, que regulam o consumo de energia no nosso organismo, influenciando, por exemplo, o uso de açúcares e o armazenamento de gordura.
A participação da microbiota intestinal como causa da obesidade tem sido extensivamente estudada nos últimos anos. Apesar de essa relação ainda não ter sido decifrada, os resultados desses estudos são muito promissores. Sabemos que camundongos geneticamente modificados que não expressam a leptina (hormônio ligado à sensação de saciedade) são obesos e têm microbiota intestinal alterada. Há um desequilíbrio entre dois principais filos bacterianos que vivem no intestino desses animais – os firmicutes e os bacteroidetes –, e essa mesma observação foi feita em humanos obesos.
Camundongos mantidos em condições especiais de laboratório e que nunca entraram em contato com nenhuma bactéria – e, portanto, não têm microbiota intestinal – apresentam sinais de desnutrição e deficiência de vitaminas, além de serem mais suscetíveis a doenças infecciosas. Quando esses animais são colonizados com a microbiota de camundongos normais, eles passam a ganhar peso rapidamente, mesmo se a disponibilidade de alimentos for menor. Se os doadores da microbiota forem animais obesos, os camundongos colonizados ganham ainda mais peso.
A correlação entre microbiota intestinal e ganho e manutenção de peso ainda não está clara. Não se sabe se é possível alterar a microbiota em longo prazo, porém, é nítido que alterações na dieta causam mudanças temporárias na composição de bactérias presentes no intestino. Pesquisadores esperam que, no futuro, seja possível criar dietas personalizadas que levem em consideração o tipo de bactérias que cada indivíduo carrega consigo.
Leandro Araujo Lobo
Juliana Soares de Sá Almeida
Regina Maria Cavalcanti Pilotto Domingues
Laboratório de Biologia de Anaeróbios,
Instituto de Microbiologia Paulo de Góes,
Universidade Federal do Rio de Janeiro