
As células precisam de energia para seu funcionamento adequado. Esta energia é obtida por meio da alimentação; principalmente, de carboidratos – como a glicose encontrada em plantas – e gorduras. Mas, para que os nutrientes sejam convertidos em energia, ocorre uma sequência de reações químicas em cada uma de nossas células, conhecida por ‘respiração celular’. De acordo com a necessidade de oxigênio para obter energia pelo processo de respiração celular, os organismos são divididos em duas categorias: anaeróbios (que não precisam do oxigênio) e aeróbios (que precisam dele).
A respiração celular começa com a glicólise (quebra de açúcar), que acontece no citoplasma das células dos organismos aeróbios e anaeróbios e resulta na formação de moléculas de piruvato. Os organismos anaeróbios transformam essas moléculas de piruvato em energia por meio da fermentação, que pode ser láctica ou alcóolica – esta última realizada por micro-organismos.
Nos organismos aeróbios, as moléculas de piruvato são processadas nas mitocôndrias (organelas do citoplasma) pelo ciclo de Krebs (ou ciclo do ácido cítrico) e pela fosforilação oxidativa (ou cadeia respiratória), com auxílio do oxigênio. Portanto, a glicólise não precisa do oxigênio para acontecer, ao passo que a segunda etapa não ocorre na ausência dele.
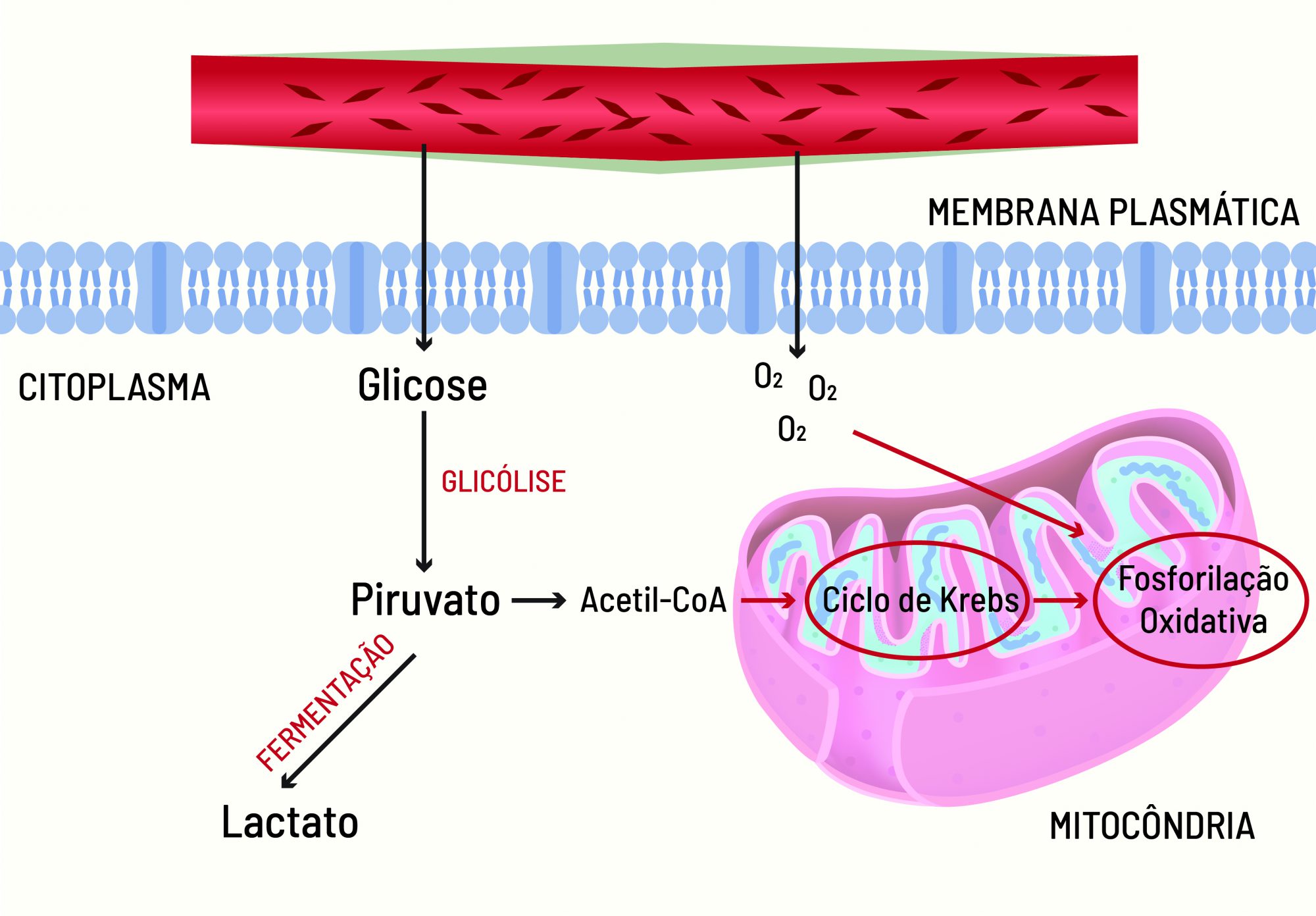
O oxigênio é transportado para todas as células de nosso corpo pelas hemácias, as células vermelhas presentes no sangue. Entretanto, apesar de ter o suprimento adequado de nutrientes, nem todas as células aeróbias têm à disposição oxigênio suficiente para seu funcionamento.
A deficiência de oxigênio em alguns tecidos é chamada hipóxia. Ela pode acontecer pelo fornecimento inadeqado de oxigênio, quando este não chega às células na quantidade apropriada ou quando as células consomem oxigênio demais e por isso ele é insuficiente. Para sobreviverem à hipóxia, as células desenvolvem mecanismos para restabelecerem a oxigenação adequada dos tecidos, ou se adaptam às novas condições fisiológicas, alterando o seu metabolismo para um processo anaeróbio.
Assim, na ausência de oxigênio, o piruvato gerado pela quebra da glicose não é utilizado pela mitocôndria e, ainda no citoplasma, é convertido em lactato via fermentação, em um processo de respiração celular anaeróbico. Esse processo, contudo, é bastante ineficiente, uma vez que gera uma quantidade de energia menor.
Os músculos são exemplos de células adaptadas à hipóxia, pois consomem o oxigênio mais rapidamente do que o recebem. Em seu metabolismo energético, são, portanto, produzidas grandes quantidades de ácido láctico que, quando acumuladas, causam a conhecida fadiga muscular e os espasmos.
Mas, como as células percebem se o suprimento de oxigênio está adequado para seu funcionamento? Nossas células estão equipadas com sensores de oxigênio; esses mecanismos conseguem medir a quantidade de oxigênio disponível, enviando avisos para nosso corpo. A existência desses sensores já era conhecida. Entretanto, a descrição molecular desse sistema rendeu a William Kaelin, Gregg Semenza e Peter Ratcliffe o prêmio Nobel de Fisiologia ou Medicina deste ano.
Segundo os ganhadores, a quantidade de oxigênio disponível para células é reconhecida por proteínas denominadas HIF (fatores induzidos por hipóxia, em tradução livre). Em condições de hipóxia, essas proteínas são produzidas e, na sequência, ativam uma série de outras proteínas que atuam no metabolismo energético da célula. Ocorre, assim, a reprogramação metabólica da célula.
A premiação coroa três décadas de pesquisa. As equipes de Semenza, da Universidade John Hopkins (EUA), e de Ratcliffe, da Universidade de Oxford (Inglaterra), estudaram a influência do oxigênio sobre a eritropoiese, mecanismo de produção dos eritrócitos (células vermelhas ou hemácias). Quanto menor a taxa de oxigênio do ambiente, mais células vermelhas são produzidas pelo nosso corpo, de forma a aproveitar ao máximo o pouco oxigênio disponível.
Esse fenômeno é observado em jogadores de futebol quando vão jogar em locais de grande altitude (e, portanto, de menos oxigênio). A dificuldade em respirar vem da falta de hemácias, que carregam o oxigênio para as células. Com o tempo, o corpo dos atletas pode se adaptar à nova situação, produzindo mais proteínas HIFs, que induzem a produção do hormônio eritropoetina que, por sua vez, vai induzir a formação de mais hemácias. Por outro lado, em locais de baixa altitude, as proteínas HIFs são destruídas, porque não há necessidade de produzir mais células vermelhas.
A eritropoiese é controlada por um hormônio chamado eritropoetina, produzido pelas células dos rins e do fígado. Ao investigarem células tumorais de fígado e rins, os pesquisadores perceberam que, mesmo com a eritropoiese controlada, o sistema sensor de oxigênio funcionava plenamente. Nesse momento, a equipe de Semenza não apenas identificou e caracterizou as proteínas HIF, como também mostrou sua presença em diversos tipos celulares que não produziam a eritropoetina. Isso indicava que as proteínas HIF tinham outros alvos além da produção desse hormônio.
Enquanto isso, em seu laboratório na Faculdade de Medicina de Harvard (EUA), a equipe liderada por Kaelin estudava a síndrome de Von Hippel-Lindau. Pacientes com essa doença são susceptíveis ao desenvolvimento de determinados tipos de tumores (como hemangioblastomas de retina e de sistema nervoso central, carcinoma das células renais, entre outros), causados por alterações no gene VHL, considerado um gene supressor de tumor.
Em geral, os tumores apresentados pelos portadores dessa síndrome são bastante vascularizados. A associação entre a falta da proteína VHL e a alta vascularização dos tumores presente nesses pacientes levou a equipe a postular a hipótese de que o gene VHL estava ligado à resposta celular aos níveis de oxigênio.
Os resultados desses trabalhos levaram à compreensão da interação das proteínas HIFs e VHL com o oxigênio, como descrito a seguir.
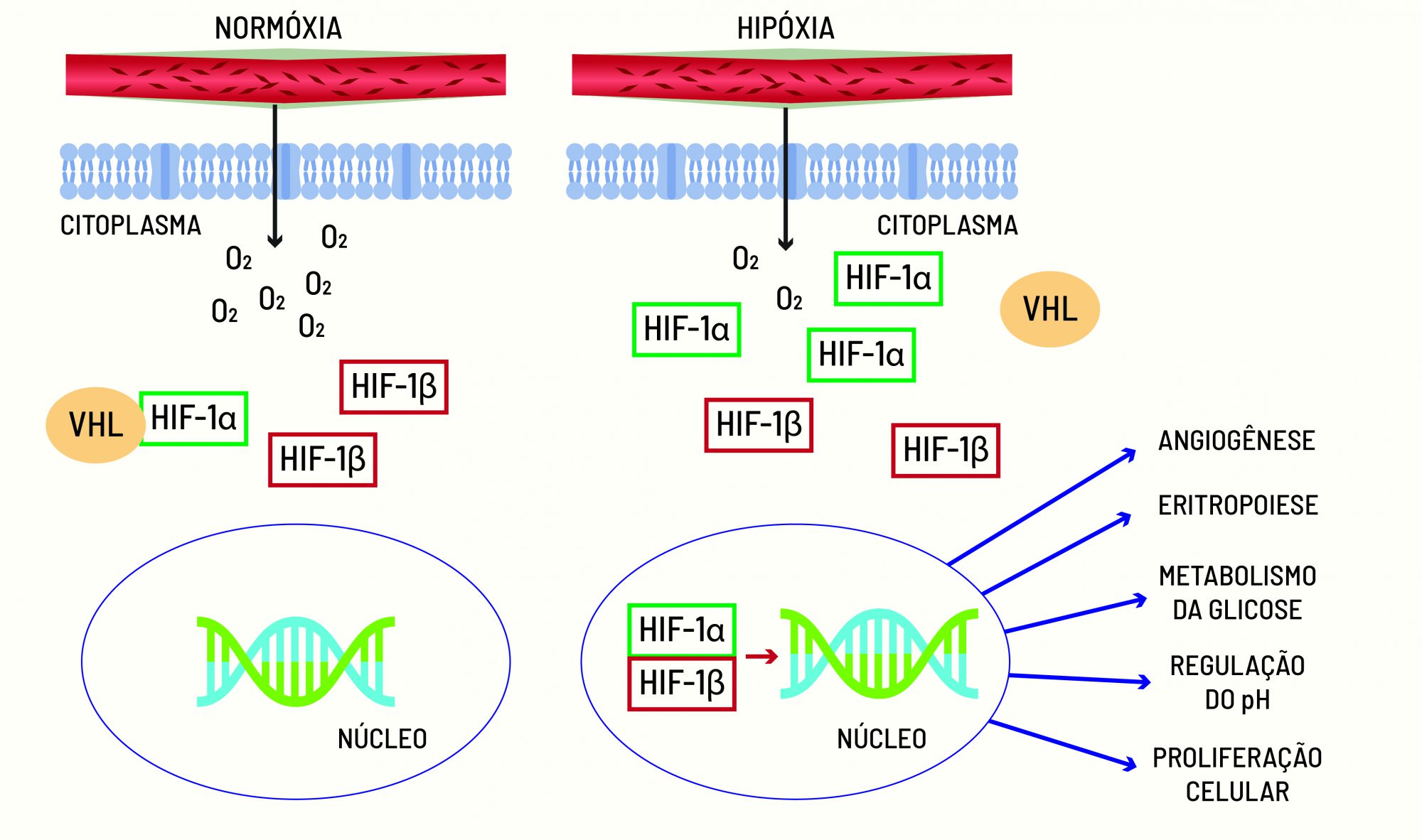
As proteínas HIF são formadas por duas proteínas menores chamadas subunidades: α (HIF-1α, HIF-2α ou HIF-3α) e β (HIF-1β). A subunidade HIF-1α é o sensor de oxigênio da célula, mas, para funcionar corretamente, ela precisa se associar à sua parceira, a HIF-1β. Quando os níveis de oxigênio são normais, essa ligação não acontece, pois a subunidade α é destruída pela proteína VHL.
A outra subunidade de HIF-1 (HIF-1β) é constantemente produzida (independentemente da taxa de oxigênio) e só se liga à HIF-1α quando seus níveis estão aumentados. Em condições normais de tensão de oxigênio, HIF-1α é degradada pela proteína supressora de tumor von Hippel Lindau (VHL). Na ausência de oxigênio (hipóxia), entretanto, HIF-1α não é degradada pela proteína VHL, o que leva à sua estabilização no interior das células.
Uma vez estável, HIF-1α funciona como um interruptor que induz a produção de fatores que melhoram a adaptação do organismo à falta de oxigênio, como a estimulação da glicólise, a eritropoiese (por meio da produção do hormônio eritropoetina), a formação de novos vasos sanguíneos (angiogênese) e, se estes processos falharem, a apoptose (morte celular). Assim, a ação das proteínas HIFs é essencial para o bom funcionamento de nosso corpo ao manter o equilíbrio do oxigênio.
Com base nesses achados, uma nova classe de medicamentos para tratar a anemia está prestes a ser disponibilizada para a população. A droga estabiliza as proteínas HIFs quando o paciente está em condições normais de tensão de oxigênio, impedindo que elas sejam destruídas. Uma vez estáveis nas células, essas proteínas vão, como mencionado anteriormente, induzir a produção de mais células vermelhas. Esse medicamento foi aprovado em 2018 para o tratamento de pacientes anêmicos, com doença renal crônica, que produzem pouca eritropoetina.
Entretanto, em algumas patologias, a ação das proteínas HIFs costumam indicar um mau prognóstico para o paciente. No câncer, por exemplo, o crescimento rápido e desordenado das células tumorais nem sempre está acompanhado de uma maior vascularização, causando uma hipóxia regional. A discrepância entre a alta taxa de crescimento tumoral e a disponibilidade de oxigênio e nutrientes faz com que sua adaptação ao ambiente de hipóxia seja a base da sobrevivência e do crescimento dessas células. Essa hipóxia induz a formação de proteínas HIFs, que levam ao aumento de proteínas GLUT1 (do inglês, glucose transporter 1, ou transportador de glicose 1), responsáveis pela entrada da glicose nas células. Quanto mais glicose entra na célula, mais glicólise acontece em seu citoplasma.
A glicólise aumentada em condições de hipóxia permite que o piruvato gerado seja convertido em ácido láctico ou lactato, que acidifica o ambiente tumoral. Em condições normais, essa acidificação seria letal para a célula. Entretanto, o tumor consegue se livrar desse ambiente ácido pela ação de outras proteínas ativadas pelo HIF conhecidas como transportadoras de monocarboxilatos (ou MCT) e anidrases carbônicas (CAs). Dessa maneira, as células tumorais com alta produção de HIFs eliminam os produtos ácidos da glicólise, o que facilita a sobrevivência e o crescimento dessas células, fazendo com que elas se adaptem às condições de hipóxia.
Esse fenômeno é visto em tumores mais agressivos ou metastáticos e, muito frequentemente, está acompanhado de resistência à quimioterapia ou radioterapia. A hipóxia é tão vantajosa para as células tumorais que, mesmo em situação de tensão normal de oxigênio, elas ‘optam’ pela via anaeróbia de produção de energia, por um mecanismo conhecido como ‘efeito de Warburg’.
Dada a importância do papel do HIF-1α no desenvolvimento e na progressão de tumores, essa proteína tem-se tornado alvo de estudos de agentes terapêuticos. Diversos grupos de pesquisa vêm estudando diferentes drogas capazes de inibir a produção das proteínas HIFs (ou das proteínas que são ativadas por elas) e, assim, impedir o desenvolvimento ou a progressão do tumor. Espera-se, com isso, a elaboração de novas drogas para o combate dos tumores mais agressivos.
A presença das proteínas HIFs nas avalições de diagnóstico e prognóstico é comumente avaliada nas biópsias do tumor. Sabe-se que um aumento da proteína HIF-1 (complexo HIF-1α e HIF-1β) está presente em 53% de todos os tipos de câncer, e em 56% a 76% dos de mama. Há situações, entretanto, em que o tumor está em locais de difícil acesso, o que dificulta ou mesmo impede a realização de biópsias.
Assim, nos últimos anos, o conceito de ‘biópsia líquida’ tem conquistado espaço cada vez maior na pesquisa e na prática clínica. Em tumores sólidos (como no caso do câncer de mama e próstata), células tumorais podem se soltar do tumor primário e permanecer no sangue dos pacientes mesmo após a remoção do tumor. A detecção e caracterização dessas células tumorais circulantes caracterizam a biópsia líquida, realizada através do exame de sangue do paciente. Essa análise permite aos clínicos acompanhar o desenvolvimento e/ou a progressão do tumor e determinar o melhor tratamento para aquele paciente.
Em um trabalho inédito, a equipe de pesquisadores do Setor de Inovação do Laboratório de Análises Clínicas do Centro Universitário Saúde ABC, da Faculdade de Medicina do ABC, localizada na cidade de Santo André (SP), identificou que as proteínas HIFs também podem ser detectadas no sangue periférico de pacientes com câncer de mama. Nessas pacientes, a quantidade de proteína HIF-1α é significativamente maior do que a encontrada no sangue de mulheres saudáveis.
Nas mulheres saudáveis, a produção de HIF-1α é normalmente encontrada em alguns tipos de células sanguíneas, tais como CD4+ (linfócito T) e em diversos tipos de células do sistema imune inato, como macrófagos, células dendríticas, neutrófilos e células Th17. Na verdade, HIF-1 α é crítica para a maturação de células dendríticas e para a ativação de células T. Assim, nas pacientes com câncer de mama, o aumento da quantidade de HIF-1 α encontrada no sangue periférico se deve à presença adicional de células tumorais circulantes.
Portanto, consideramos que a avaliação da quantidade de proteínas HIFs no sangue periférico pode ser uma ferramenta laboratorial útil para complementar o diagnóstico do câncer de mama, além de servir para acompanhamento das pacientes em tratamento e de mulheres com histórico familial de câncer de mama. Afinal, trata-se de um método pouco invasivo, de baixo custo e com alto potencial diagnóstico (sensibilidade de 98,15% e especificidade de 96%).
O conhecimento sobre os mecanismos que levam à adaptação celular para a diversas condições de disponibilidade de oxigênio no ambiente gerou não apenas um prêmio Nobel, mas, principalmente, a possibilidade de criar novas drogas para o combate de anemia e câncer, bem como de desenvolver novos testes para a predição e/ou estratificação de alguns tipos de doenças crônicas.
Beatriz da Costa Aguiar Alves Reis
Centro Universitário Saúde ABC
Faculdade de Medicina do ABC

Para se posicionar a favor ou contra, o que pode ser melhor do que conversar com um especialista? O professor e pesquisador Luís Fernando Tófoli, do Departamento de Psicologia Médica e Psiquiatria da Unicamp, está no chat da Ciência Hoje para dialogar com você sobre os limites e os benefícios do uso medicinal da maconha. Participe!
Doença causada pelo parasita Toxoplasma gondii atinge milhões de brasileiros, com consequências graves para a saúde pública. Pesquisadores estão propondo alternativas de tratamento para acelerar o processo de descoberta de novos medicamentos e assim beneficiar os pacientes.

A exploração do espaço voltou a ganhar momento, com a entrada em cena não só de novas agências espaciais, mas também de empresas que exploram comercialmente essa atividade. A tensão ideológica que marcou esse campo foi substituída pela cooperação

O mercado de sementes modificadas e dependentes de pesticidas tóxicos à saúde e ao ambiente está cada vez mais concentrado em algumas poucas megaempresas. É essencial visibilizar as formas de produção por trás do que comemos para alcançar alternativas saudáveis e justas

Há 50 anos, o lançamento do satélite Landsat-1 transformou nosso olhar sobre a superfície terrestre. Hoje, as técnicas de machine learning e deep learning promovem uma nova revolução, desta vez na “visão” dos computadores e no sensoriamento remoto do planeta

A pele – maior órgão do corpo humano – é habitada por uma vasta e diversa comunidade de micro-organismos, a microbiota. Esses seres invisíveis não só nos protegem contra doenças e alergias, mas também afetam nosso odor corporal, tornando-nos mais (ou menos) atraentes para insetos.

Há cerca de mil anos, a explosão de uma estrela no céu revelou pela primeira vez a luz síncrotron, radiação emitida por partículas elétricas e ultravelozes. Hoje, essa luz – agora gerada por aceleradores, como o Sirius, no Brasil – é uma ferramenta importante da ciência

As atividades de mineração da empresa Braskem em Maceió (AL) causaram o afundamento do solo, o que fez com que cerca de 60 mil pessoas tivessem que deixar suas casas. Essa população de deslocados internos ambientais ainda espera por compensações

Gases nobres são ditos inertes por não reagirem com outros elementos. Porém, depois de mais de um século de pesquisa, a química avançou na compreensão das condições com que esses elementos formam compostos. Hoje, vários derivados deles são conhecidos na Terra e no espaço.

Em um mundo que pede por soluções sustentáveis, a microbiologia tem papel importante: o uso de microrganismos para a fabricação de bioprodutos ‘verdes’. Planta-piloto em uma universidade brasileira promete impulsionar de forma pioneira a área no país
| Cookie | Duração | Descrição |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |
