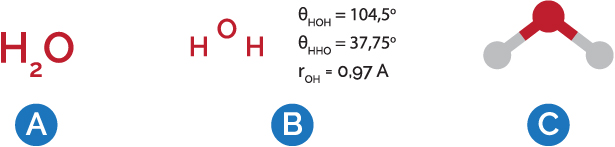
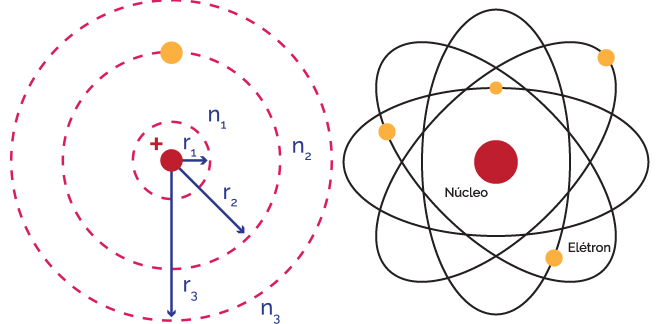
Essas formulações teóricas só se aplicavam a átomos hidrogenoides, ou seja, com um único elétron. Mas Bohr, em sua famosa trilogia de artigos de 1913, propôs uma forma de distribuir os elétrons dos átomos pelas diferentes órbitas – cada órbita comportando certo número de elétrons.
Curiosamente, à exceção do átomo de hélio (com dois elétrons), os átomos dos demais gases nobres – neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn) –, na distribuição proposta por Bohr, apresentavam oito elétrons na última órbita, ou camada, ocupada. Uma característica desses elementos – já bem conhecida à época – era a inércia química, ou seja, a incapacidade de se combinar com outros elementos para formar moléculas.
Dos chamados modelos eletrônicos da ligação química, o proposto, em 1916, pelo físico-químico estadunidense Gilbert Lewis (1875-1946), foi de longe o mais frutífero. Lewis associou a inércia química dos gases nobres à peculiar distribuição de elétrons, que, em sua visão, conferiria estabilidade aos átomos desses elementos, evitando que eles se combinassem com outros átomos.
Lewis imaginou que a formação de moléculas poderia se dar pelo compartilhamento de elétrons da última camada, de forma que cada um dos átomos passasse a exibir oito elétrons em suas camadas – o que conferiria estabilidade à molécula.
Seguindo essa linha de raciocínio, Lewis propôs que uma ligação química resultaria de átomos compartilhando um par de elétrons.