A essa altura, podemos voltar aos insetos que caminham sobre a água e às gotas que se formam na chuva ou no orvalho. Por que esses fenômenos acontecem? A propriedade por trás disso: a tensão superficial, relacionada com a resistência da superfície de um líquido em ser estendida.
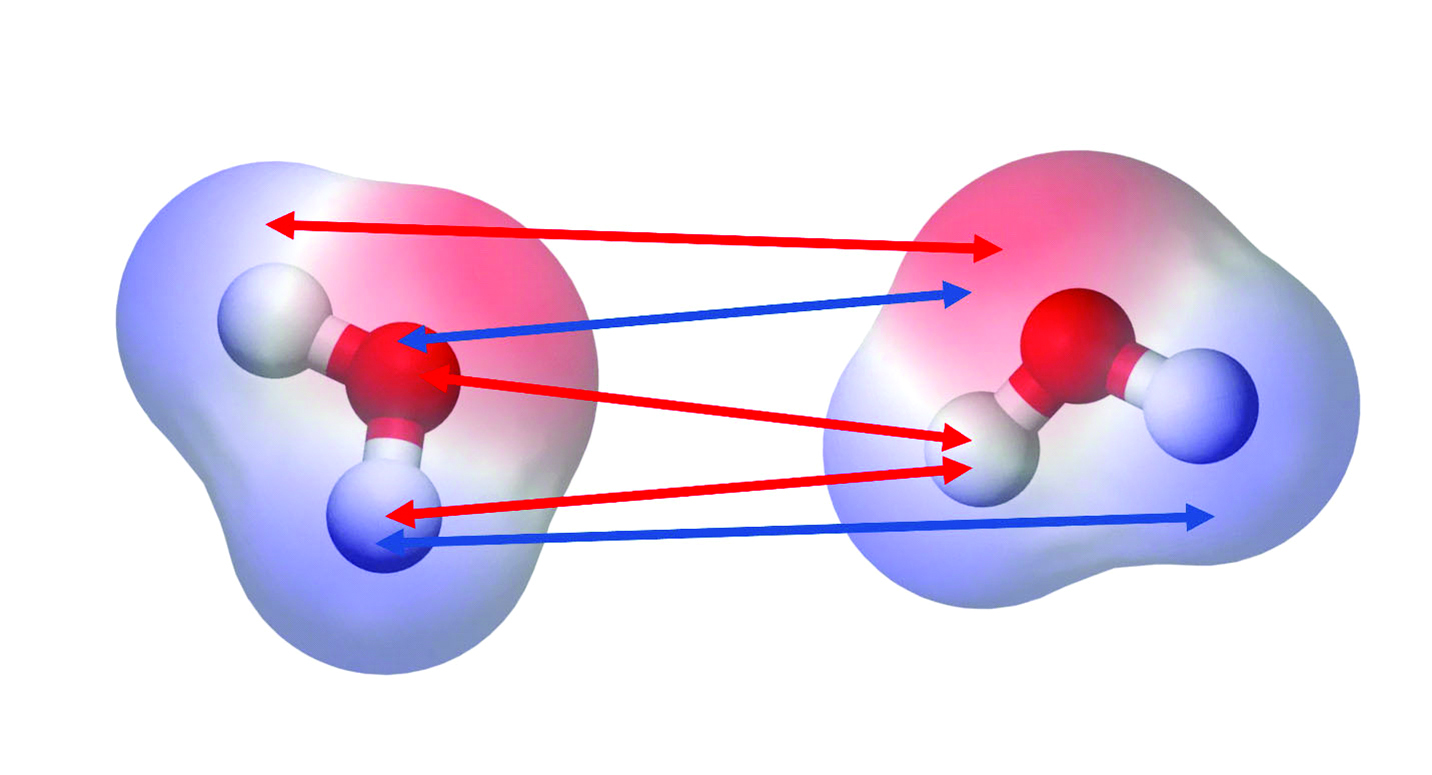
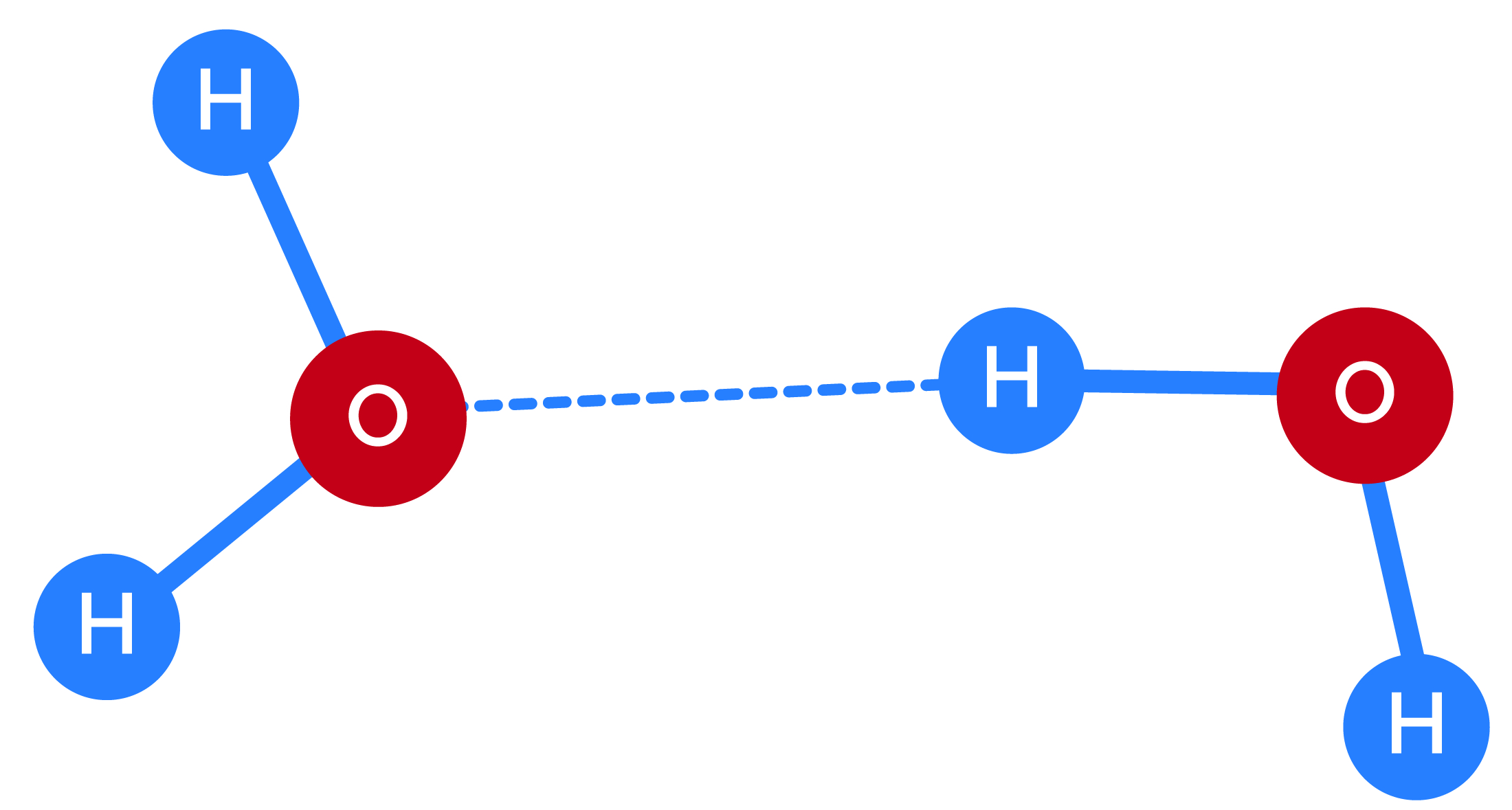
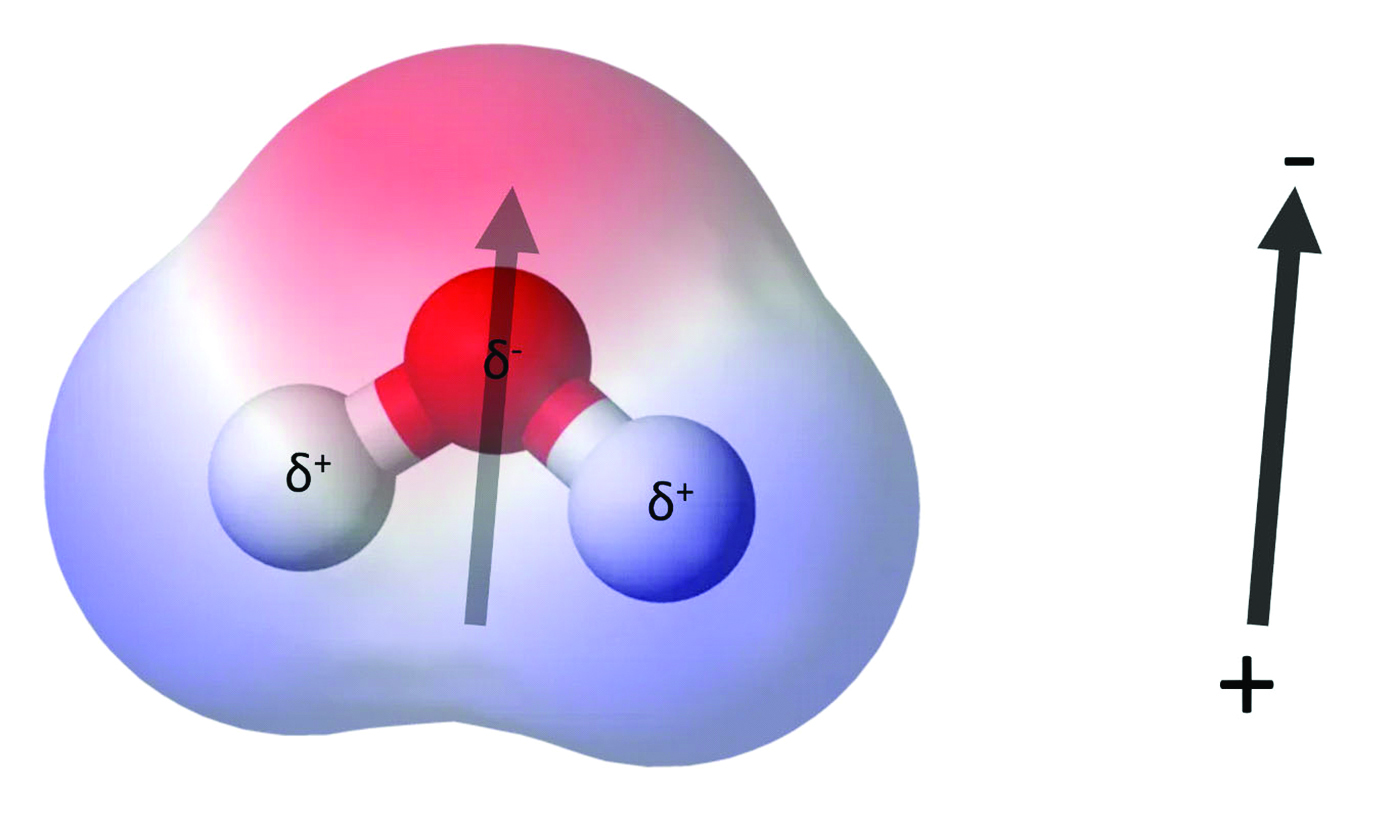
As moléculas no interior de um líquido experimentam interações atrativas, como as forças de van der Waals e as ligações de hidrogênio. Mas aquelas na superfície têm menos ‘vizinhos’, o que significa menos interações.
Isso significa que cada molécula que se desloca para a superfície vai diminuir suas interações atrativas. O resultado é que é preciso certo esforço de uma molécula para chegar à superfície – principalmente, se as forças atrativas forem grandes no líquido em questão.
Na água, as interações intermoleculares são fortes e atrativas. Portanto, a superfície é resistente e consegue suportar pequenos insetos e objetos sem se romper – é possível, com algum cuidado, fazer uma lâmina de barbear, por exemplo, flutuar sobre a superfície da água.
Quanto aos insetos, muitos têm pernas com grande área superficial e dotadas de substâncias que interagem fracamente com a água, aumentando ainda mais a resistência da superfície em cobri-las.
E as gotas? A tensão superficial também é responsável pelo formato esférico delas, porque este tem menor razão entre área e volume. Nesse formato, as moléculas de água interagem mais entre si, tornando essa configuração bem estável – em tempo: tudo isso depende das interações entre as moléculas do líquido.