Essa família de elementos inclui o hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn). Suas propriedades físicas notáveis incluem não só uma densidade baixa, mas também uma emissão luminosa bem característica como resposta à absorção de energia de uma fonte.
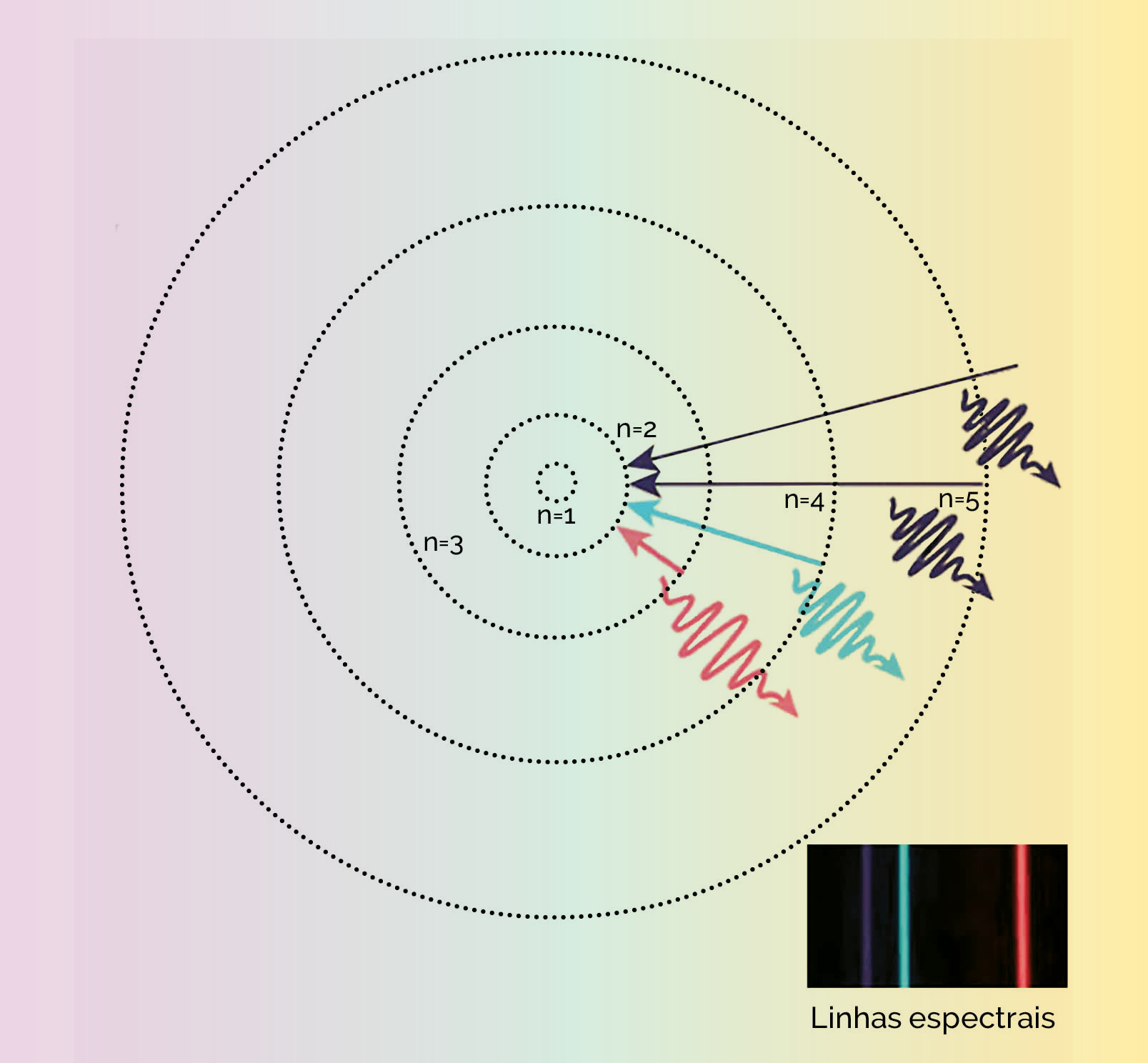
Cada um dos 118 tipos de átomos, ao absorverem energia e passarem a um estado denominado ‘excitado’, emite luz em ‘cores’ (frequências) muito específicas. O conjunto dessas emissões – caracterizado por linhas finas, coloridas e descontínuas entre si – é chamado espectro luminoso (ou eletrônico).
Essas linhas espectrais atuam como uma ‘impressão digital’, o que possibilita a identificação precisa do elemento que a está emitindo. A origem dessas linhas espectrais está baseada no fato de os elétrons de cada elemento químico responderem de modo muito particular à energia que eles absorvem.
De modo geral, os elétrons, ao ganharem energia extra, ‘saltam’ para níveis de energia mais elevados, ou seja, mais distantes do núcleo atômico. Em seguida, retornam ao seu estado original, liberando a energia absorvida na forma de luz. Esse processo é realizado de forma única por cada tipo de elemento (figura 1).
No cotidiano, a emissão luminosa intensa dos gases nobres é observada nos letreiros de ‘luz néon’ – no caso, a energia extra vem de uma fonte elétrica. Encontramos também, no dia a dia, aplicações da baixa densidade desses gases: os balões de hélio, que flutuam, por serem mais ‘leves’ que o ar.





























Lurdinha
Esse texto é dissertativo argumentativo?