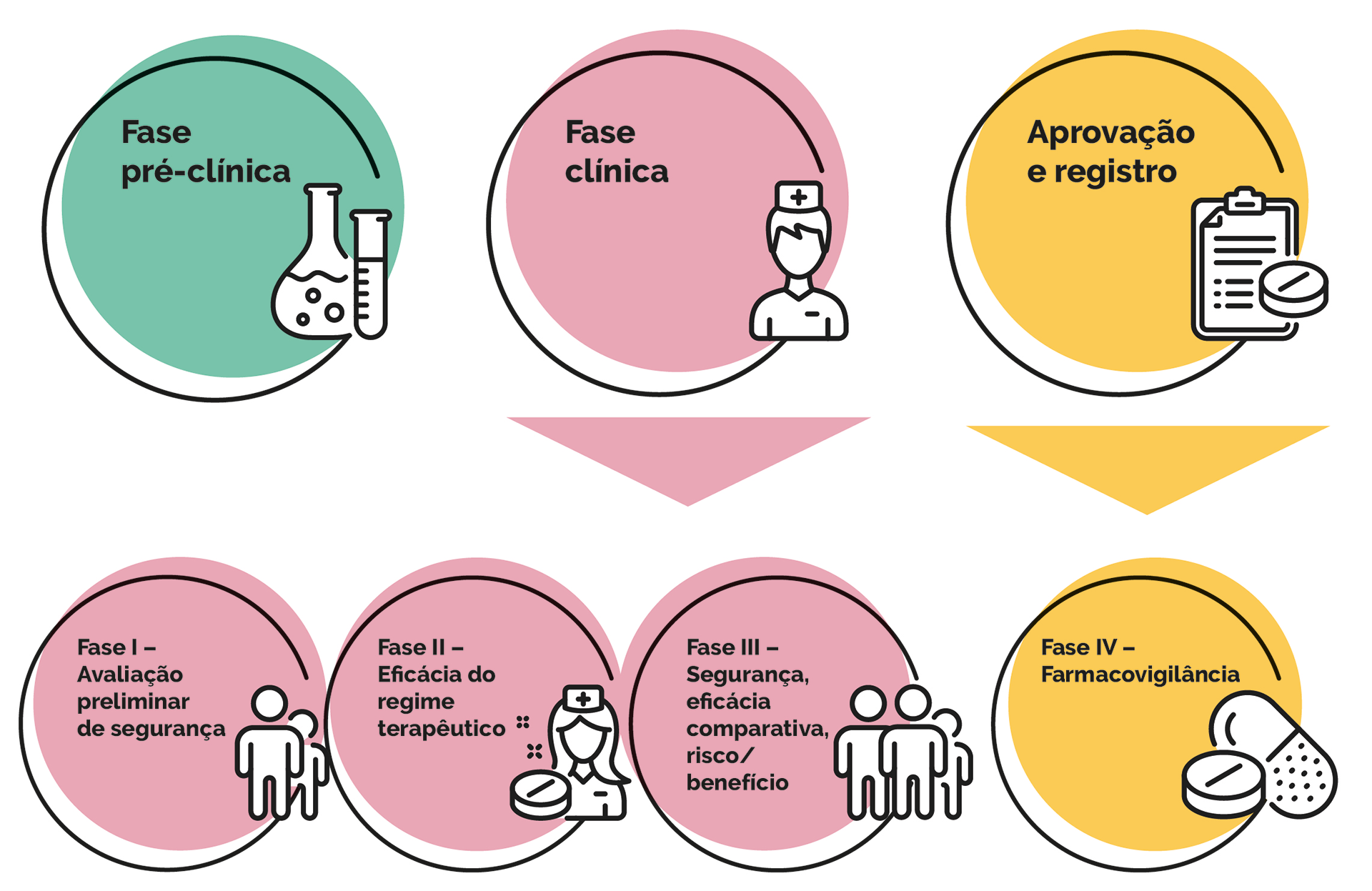
Nessa fase, são feitos estudos em laboratório, nos quais os candidatos a fármacos são testados in sílico (em computadores); in vitro (em sistemas biológicos isolados, como células isoladas cultivadas em tubos de ensaio); e in vivo (em modelos animais), para verificar a eficácia e a toxicidade dos compostos químicos em estudo.
Na pesquisa clínica, a segurança e a eficácia dos candidatos a fármacos são avaliadas em humanos. Essa etapa divide-se em quatro fases (figura 1): i) fase I, em que ocorre a avaliação da segurança preliminar com base em pequeno grupo de participantes saudáveis; ii) fase II, na qual se avalia a eficácia do regime terapêutico (dosagem e frequência), a partir de pequeno grupo de participantes enfermos; iii) fase III, quando acontece a avaliação do risco/benefício, efeitos adversos, contraindicações, segurança e eficácia comparativa em relação aos tratamentos existentes ou placebo (substâncias inócuas), empregando estudos randomizados (aleatórios) e multicêntricos, com grupos de participantes grandes e variados.
A última fase (IV), conhecida como farmacovigilância, se dá depois da aprovação do registro, visando a identificar e avaliar efeitos adversos relacionados ao uso em larga escala do novo fármaco aprovado.
Todos esses passos são extremamente rigorosos e demandam elevado custo intelectual, financeiro e de tempo.