
Do lápis ao diamante, do carboidrato à proteína, do DNA à respiração. O carbono, conhecido como o ‘elemento da vida’, está presente em tudo isso e muito mais. Nós, humanos, e todos os organismos vivos da Terra somos constituídos por muitas moléculas baseadas em carbono. A incrível versatilidade desse elemento permite que ele esteja no simples carvão do churrasco e que forme materiais complexos como os nanotubos de carbono, com inúmeras aplicações na vida moderna. Por outro lado, é considerado o grande vilão do aquecimento global, embora a responsabilidade pelo aumento de suas emissões seja, na verdade, dos humanos.
Sem ele, a vida não seria possível. O carbono, primeiro elemento do grupo 14 da tabela periódica, é o principal responsável pela vida na forma como a conhecemos. Tudo que é vivo na Terra é constituído por um grande número de moléculas baseadas em carbono, que, junto com nitrogênio, hidrogênio e oxigênio, corresponde a praticamente 98% dos elementos químicos presentes em qualquer organismo. Mas, nesse quarteto, o papel central é do carbono
O carbono é o sexto elemento mais abundante do universo, mas é o 19° em quantidade na crosta terrestre, representando 0,025% dos elementos químicos existentes – o oxigênio está em primeiro lugar, com aproximadamente 50%, seguido de 26% de silício, 8% de alumínio, 5% de ferro, 4% de cálcio, 3% de sódio. Apesar de estar em menor quantidade em nosso planeta, o carbono é responsável por um número de compostos e moléculas conhecidas maior do que todos os outros elementos juntos.
O nome carbono é originário da palavra grega carbo, que significa carvão. A primeira descrição do carbono como elemento químico se deu em 1779 pelo químico francês Antoine Lavoisier (1743-1794), considerado o pai da química moderna. Mas seu uso é bem mais antigo. Há registros da utilização do carvão pelo ser humano desde a pré-história, e evidências de que os chineses conheciam o diamante em aproximadamente 2.500 a.C. Sabe-se também que algumas civilizações no sudeste da Europa usavam grafite como pigmento para decoração por volta de 4.000 a.C.
A vida escolheu o carbono por um motivo simples: é o único elemento com estrutura atômica adequada à formação de ligações químicas estáveis e variadas com um número grande de elementos químicos. E mais importante ainda: apresenta fantástica capacidade de se ligar a outros átomos de carbono, originando moléculas com diferentes tamanhos e arranjos. Essas amplas possibilidades permitem a ocorrência de moléculas simples como o CO2, que expelimos durante a respiração, e de moléculas com alto grau de complexidade, como o DNA, que contém toda a informação relacionada à nossa individualidade.
Mas por que determinados átomos são mais propícios a se ligar a outros? No caso do carbono, isso se deve à sua configuração eletrônica, ou seja, a forma como seus seis elétrons estão dispostos energeticamente. Tal disposição possibilita muitas alternativas, incluindo ligações consigo próprio – criando cadeias ou conglomerados de átomos ligados, o que faz com que o número de combinações seja incontável. Assim, é praticamente infinito o número de moléculas baseadas em carbono!
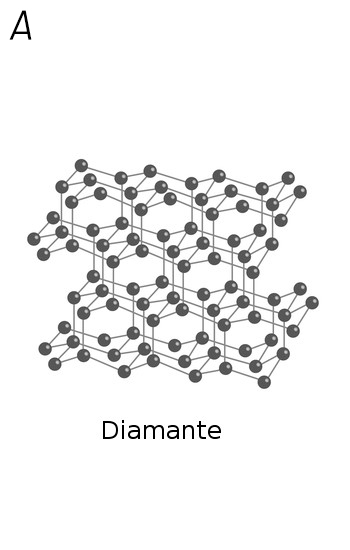
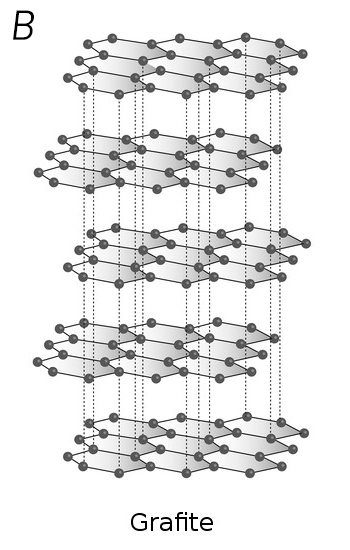
Parece impossível acreditar, mas o diamante e o grafite (usado nos lápis) possuem exatamente a mesma composição química: somente átomos de carbono. Mas, se são formados exclusivamente pelo mesmo elemento químico, como podem ser tão diferentes? A resposta está na característica que faz do carbono o ‘elemento da vida’: as diversas formas como seus átomos de carbono se ligam e se organizam são capazes de originar substâncias muito diferentes.
No diamante, cada átomo de carbono está diretamente ligado a outros quatro, que, por sua vez, estão ligados a outros quatro, e assim sucessivamente.
Já no grafite, cada átomo de carbono se liga a outros três, todos no mesmo plano, formando estruturas que se parecem com o desenho de uma colmeia, originando folhas planares com um único átomo de espessura. Várias dessas folhas se empilham umas sobre as outras, como se fossem um pão de forma ou um monte de cartas de baralho, formando o grafite.
Uma das propriedades do grafite é sua ‘maciez’, que se deve justamente ao deslizamento dessas folhas umas sobre as outras, por fricção. Quando escrevemos, o pedaço de grafite que sai do lápis e fica grudado no papel foi rompido por esse deslizamento das folhas, causado pela fricção do papel sobre o lápis. Já o diamante é extremamente duro, decorrente da estrutura formada pelas quatro ligações químicas de cada átomo.
Mas, além do diamante e do grafite, existem outras substâncias formadas somente por átomos de carbono: em 1985, foi descoberto o fulereno, um composto molecular representado pela fórmula C60. Nessa molécula, os 60 átomos de carbono estão ligados uns aos outros formando uma estrutura esférica, possível de ser atingida por meio da alternância de pentágonos e hexágonos, como uma bola de futebol perfeita
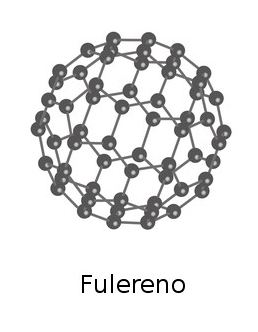
Os três cientistas envolvidos na descoberta da molécula de fulereno – Henry Kroto, da Universidade de Sussex, Inglaterra; Robert Curl e Richard Smalley, ambos da Universidade Rice, nos Estados Unidos – foram premiados com o Nobel de Química em 1996.
Um pouco antes disso, em 1991, o químico japonês Sumio Iijima, ao observar amostras de fulereno em um microscópio eletrônico de transmissão, notou a presença de outras estruturas bastante diferentes e intrigantes. Depois de analisá-las, o cientista se deu conta de que as estruturas se tratavam de uma nova substância elementar formada somente por carbono. Assim, se deu uma das mais fantásticas descobertas recentes da ciência: os nanotubos de carbono.
Sabe aquela folha onde cada átomo de carbono se liga a outros três, formando uma estrutura planar que se parece com uma colmeia, e cujo empilhamento dá origem ao grafite? Imagine que essa folha pode se enrolar, formando tubos, mas com uma característica peculiar: o diâmetro desses tubos está na faixa de alguns nanômetros (um nanômetro corresponde a um bilionésimo de metro, que é 10-9 m ou 0,000000001 m. Para efeito de comparação, 1 nanômetro é 70 mil vezes menor que o diâmetro de um fio de cabelo). Essa é a estrutura dos nanotubos de carbono.
Existem diferentes formas de enrolar uma folha de átomos de carbono. Pode-se também enrolar várias folhas juntas, formando tubos com várias folhas concêntricas. Cada uma dessas possibilidades origina um nanotubo de carbono diferente, que se caracteriza pelo número e pela maneira com que as camadas concêntricas estão enroladas e pelo diâmetro do tubo.
A descoberta dos nanotubos de carbono causou grande alvoroço na comunidade científica pela beleza da sua estrutura, mas, principalmente, pelas propriedades fantásticas desses alótropos (substâncias diferentes formadas pelo mesmo elemento químico). São os materiais com a maior resistência mecânica conhecida, mas são também extremamente leves; podem ser mais condutores que o cobre, ou então apresentar propriedades de um semicondutor como o silício; além de transportarem melhor o calor do que qualquer outra substância.
Por todas essas características, são muitas as possibilidades de aplicação útil dos nanotubos de carbono. Praticamente todas as áreas do conhecimento relacionadas ao nosso cotidiano são ou serão impactadas por esse material: agricultura, medicina, cuidados pessoais, informática, eletrônica, química, física, biologia, comunicações, engenharias etc.
Vários produtos contendo nanotubos de carbono já estão no mercado, entre eles, materiais esportivos de alto desempenho (bicicletas de corrida, raquetes de tênis, remos, tacos de beisebol etc.), equipamentos eletrônicos como celulares e tablets, células solares, plásticos resistentes, para-choques de automóveis e tintas condutoras.
Mas esse versátil carbono ainda tem outra face. Lembra-se daquela folha onde cada átomo de carbono se liga a outros três, formando uma estrutura planar que se parece com uma colmeia? Aquela que empilhada dá origem ao grafite e enrolada forma o nanotubo de carbono? Imagine agora essa folha isolada. Essa é a estrutura do grafeno, outra substância elementar formada somente por átomos de carbono e considerada o material mais fino que se conhece (tem a espessura de um único átomo de carbono, com dimensões laterais que podem chegar até a centímetros). Foi isolado a partir do grafite em 2004, pelos cientistas André Geim e Konstantin Novoselov, da Universidade de Manchester, na Inglaterra, que, por esse trabalho, conquistaram o Prêmio Nobel de Física de 2010.
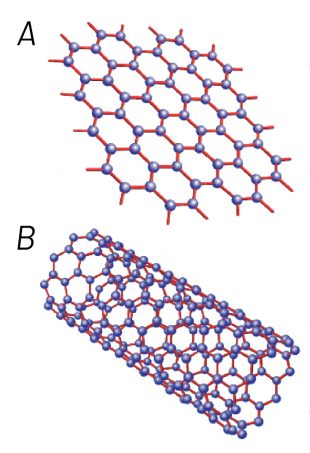
O grafeno apresenta propriedades singulares por sua peculiar espessura monoatômica. Isso faz com que os elétrons presentes na sua estrutura fiquem livres para se movimentar e não sejam perturbados pelos elétrons de folhas adjacentes. Essa substância também apresenta propriedades mecânicas e térmicas muito parecidas com as dos nanotubos de carbono, o que lhes confere também inúmeras aplicações tecnológicas.
E a lista não para por aí: o carbono ainda constitui outras substâncias com estruturas não claramente definidas, porque os átomos não adotam posições regulares e nem se comportam da mesma maneira. As estruturas com essas características – genericamente conhecidas como carbono amorfo – também contêm certa quantidade de outros elementos, como oxigênio e hidrogênio. O carvão, a fuligem, o negro-de-fumo e o carbono vítreo são alguns dos representantes dessa classe de materiais.
O carbono pode ficar estocado em mares, rios, solos, vegetação, atmosfera e seres vivos. A representação de onde (e como) o carbono está estocado e como o elemento se movimenta de um desses reservatórios a outro é chamada de ciclo do carbono. Esse ciclo é complexo e costuma ser dividido em um componente geológico (relacionado ao transporte de carbono da atmosfera para solos e oceanos, em processos que duram milhões de anos) e um componente biológico, que acontece em uma escala de tempo muito menor e envolve basicamente (mas não exclusivamente) os processos de respiração (liberação de carbono na forma de CO2 para a atmosfera) e de fotossíntese (captura do CO2 atmosférico pelas plantas).
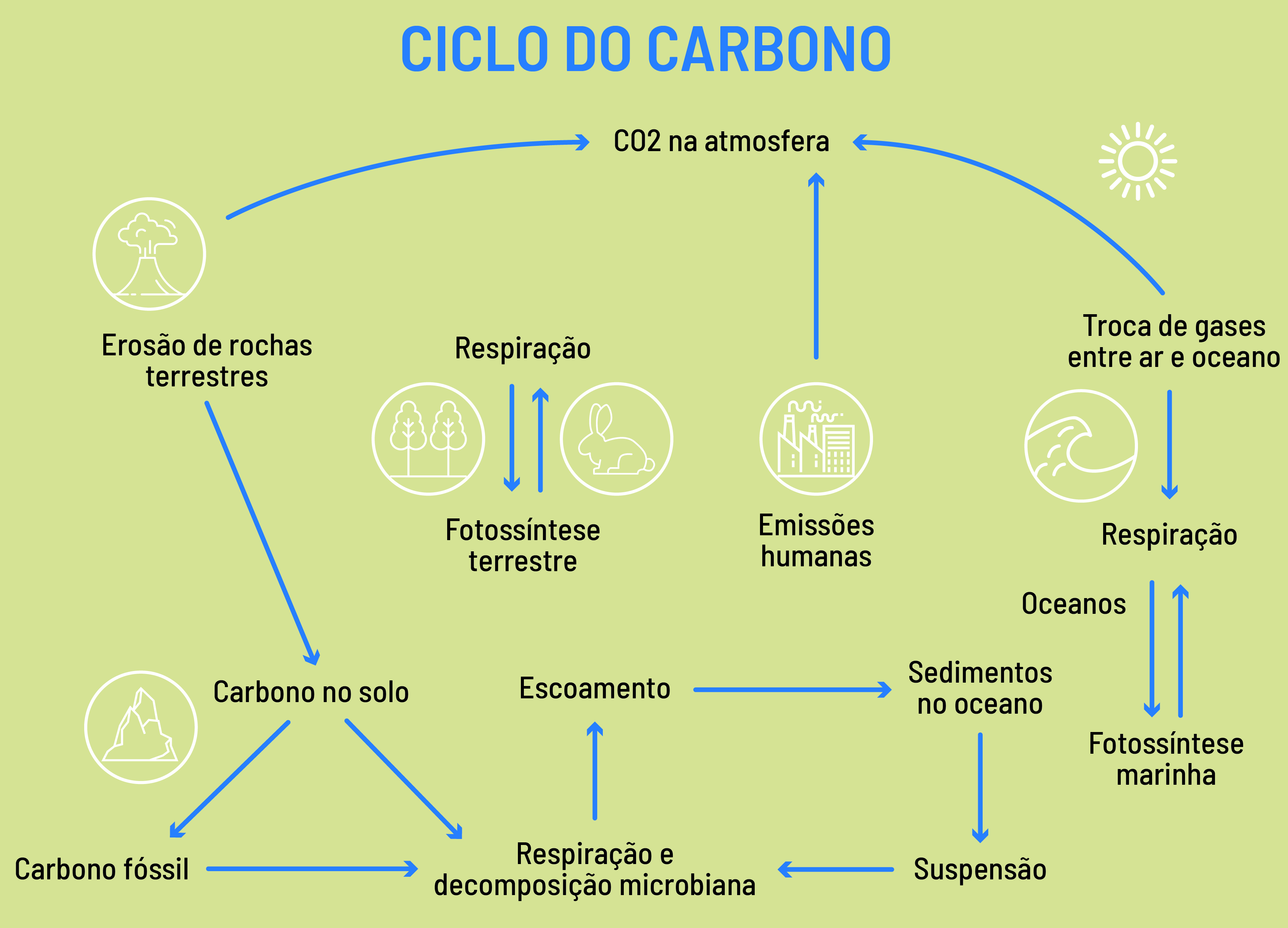
Por meio da fotossíntese, utilizando água e a energia da luz solar, as plantas absorvem o CO2 do ar para produzir glicose. Enquanto plantas e organismos vivos usam diferentes carboidratos para gerar energia para seu próprio metabolismo, a respiração faz o processo inverso, liberando CO2 para a atmosfera.
Além da fotossíntese e da respiração, o componente biológico do ciclo do carbono envolve outros processos, como a conversão de espécies enterradas (após a morte) nos chamados combustíveis fósseis, como o petróleo, que, ao ser extraído e usado como combustível, devolve o CO2 à atmosfera.
Com o processo de industrialização e aumento da demanda energética, o ser humano tem aumentado sobremaneira o uso de combustíveis fósseis, o que tem causado um aumento nas taxas de emissão de CO2 para a atmosfera, desequilibrando o ciclo do carbono. Ou seja, muito mais gás carbônico está chegando à atmosfera do que a quantidade que pode fazer o caminho inverso pelos processos conhecidos. O desmatamento crescente também contribui para esse desequilíbrio.
O excesso de gás carbônico é o principal responsável pelo chamado ‘efeito estufa’, que aumenta o aquecimento global do planeta, devido ao excesso de CO2 que se acumula na atmosfera e impede que a radiação infravermelha (responsável pelo calor que sentimos quando ficamos sob o Sol) refletida pela superfície da Terra seja dissipada. O resultado é um aumento da temperatura média do planeta, que causa prejuízos à vida (pois o metabolismo de vários microrganismos é alterado), além de provocar derretimento de gelo acumulado nas calotas polares, o que aumenta o nível dos mares e oceanos, podendo levar a inundações, maremotos e tsunamis.
A diminuição da taxa de emissão de CO2 para a atmosfera deve ser encarada como um dos grandes desafios para a humanidade, e depende de ações políticas e de mudanças comportamentais, como o contínuo investimento em novas formas de geração de energia que não dependam de combustíveis fósseis, a substituição dos automóveis tradicionais pelos veículos elétricos e pelo transporte coletivo, entre tantas outras. O vilão do meio ambiente, portanto, não é o carbono (como muitos pensam), mas sim o ser humano, responsável por sua emissão de forma desgovernada.
Aldo J.G. Zarbin
Departamento de Química,
Universidade Federal do Paraná

Eles são usados em aeroportos para testes de triagem de suspeitos de carregarem ou terem tido contato com explosivos. Mas esses equipamentos são totalmente confiáveis? Estudo de um grupo de pesquisadores brasileiros atacou essa questão. E a resposta foi surpreendente.
Doença causada pelo parasita Toxoplasma gondii atinge milhões de brasileiros, com consequências graves para a saúde pública. Pesquisadores estão propondo alternativas de tratamento para acelerar o processo de descoberta de novos medicamentos e assim beneficiar os pacientes.

A exploração do espaço voltou a ganhar momento, com a entrada em cena não só de novas agências espaciais, mas também de empresas que exploram comercialmente essa atividade. A tensão ideológica que marcou esse campo foi substituída pela cooperação

O mercado de sementes modificadas e dependentes de pesticidas tóxicos à saúde e ao ambiente está cada vez mais concentrado em algumas poucas megaempresas. É essencial visibilizar as formas de produção por trás do que comemos para alcançar alternativas saudáveis e justas

Há 50 anos, o lançamento do satélite Landsat-1 transformou nosso olhar sobre a superfície terrestre. Hoje, as técnicas de machine learning e deep learning promovem uma nova revolução, desta vez na “visão” dos computadores e no sensoriamento remoto do planeta

Nas matas brasileiras, a biodiversidade é exuberante. Plantas gigantescas e animais imponentes. Mas os mistérios podem se esconder nos detalhes. Esse é o caso de um sapinho ‘surdo’ e ‘brilhante’, cuja anatomia miniaturizada segue intrigando os biólogos

Comunidades indígenas pré-coloniais já praticavam formas de urbanismo. Hoje, as mídias sociais são aliados na busca por uma representação mais justa dessas populações, que, com frequência e de forma errônea, são consideradas desconectadas de suas tradições, culturas e terras.

Alunos buscam tema sobre sustentabilidade para uma feira de ciências da escola. Um especialista sugere o seguinte: células solares, que geram energia elétrica a partir da luz – e não poluem o meio ambiente. Hoje, essa tecnologia está amplamente presente em nosso cotidiano

O chamado ‘problema da medição’ na mecânica quântica tem ajudado especialistas a responder a perguntas profundas, quase filosóficas, como: ‘os resultados experimentais são realmente objetivos?’ e ‘há uma fronteira real entre os mundos macro e microscópico?’

O arsênio ganhou fama por ser o veneno usado pela nobreza para matar inimigos, parentes ou amantes. Mas há uma face realmente nobre – e pouco revelada – desse elemento químico: é um fármaco usado ao longo da história para tratar várias doenças
| Cookie | Duração | Descrição |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |
